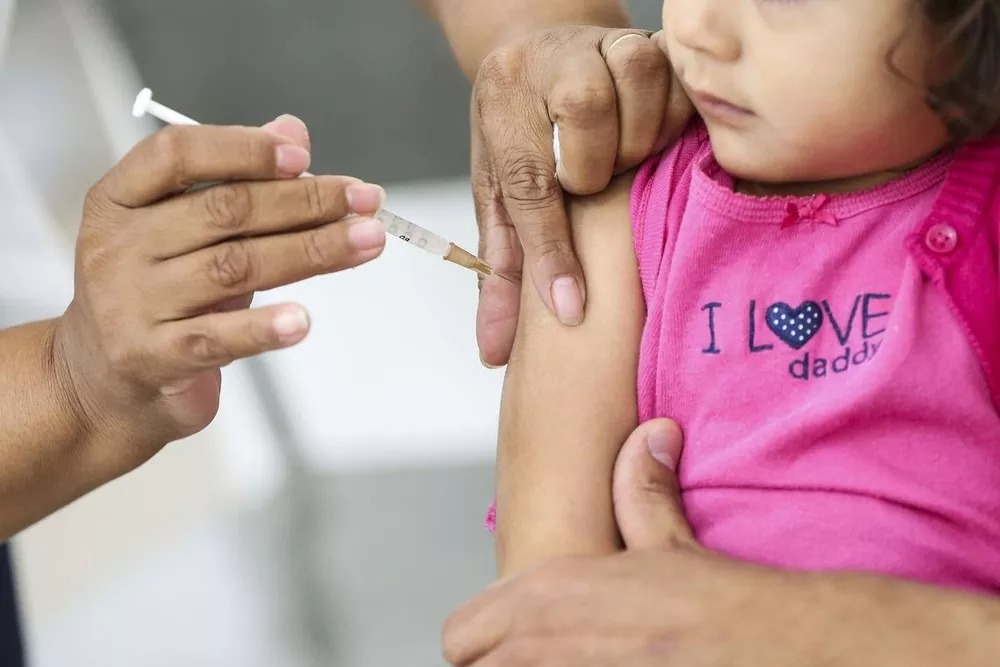
Uma decisão dos Estados Unidos sobre a vacina da Pfizer e BioNTech contra a Covid-19 para crianças de 6 meses a 4 anos de idade foi adiada por pelo menos dois meses depois que Agência de Alimentos e Medicamentos (FDA), equivalente à Anvisa, disse que precisava de mais dados.
A FDA planejava tomar uma decisão sobre a vacina com base nos dados iniciais dos testes por causa do que chamou de “grande necessidade de saúde pública devido ao aumento de infecções causadas pela variante Ômicron do coronavírus“. A decisão estava prevista para a próxima semana.
Nesta sexta-feira (11), a agência disse que revisou novas informações de testes que chegaram desde o pedido de autorização de emergência da Pfizer e decidiu que precisava de mais dados antes de avançar.
“Se algo não atende a esse padrão, não podemos prosseguir”, disse Peter Marks, diretor do Centro de Avaliação e Pesquisa Biológica da FDA. Marks observou que alguns dos novos dados que levaram a FDA a adiar a decisão foram “de última hora”.
A Pfizer e a BioNTech enviaram dados sobre as duas primeiras doses do que foi planejado como um regime de três doses para essa faixa etária no início deste mês, a pedido da FDA. Não foram divulgados dados de eficácia.
AliançA FM